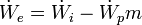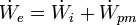Calor
El calor se define como la transferencia de energía térmica que se da entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintastemperaturas, sin embargo en termodinámica generalmente el término calor significa transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.
Historia del concepto[editar]
Hasta el siglo XIX se explicaba el efecto del ambiente en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamado calórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calórico afirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que el trabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
Calor específico[editar]
El calor específico es la energía necesaria para elevar 1 °C la temperatura de un gramo de materia. El concepto de capacidad calorífica es análogo al anterior pero para unamasa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
donde:
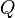 es el calor aportado al sistema.
es el calor aportado al sistema.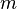 es la masa del sistema.
es la masa del sistema. es el calor específico del sistema.
es el calor específico del sistema.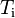 y
y 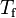 son las temperaturas inicial y final del sistema respectivamente.
son las temperaturas inicial y final del sistema respectivamente. es el diferencial de temperatura.
es el diferencial de temperatura.
Las unidades más habituales de calor específico son J / (kg · K) y cal / (g · °C).
El calor específico de un material depende de su temperatura; no obstante, en muchos procesos termodinámicos su variación es tan pequeña que puede considerarse que el calor específico es constante. Asimismo, también se diferencia del proceso que se lleve a cabo, distinguiéndose especialmente el "calor específico a presión constante" (en un proceso isobárico) y "calor específico a volumen constante (en unproceso isocórico).
De esta forma, y recordando la definición de caloría, se tiene que el calor específico del agua es aproximadamente:
Calor específico molar[editar]
El calor específico de una sustancia está relacionado su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. A altas temperaturas la mayoría de sólidos tienen capacidades caloríficas molares del orden de  (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 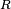 la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
 (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 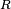 la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
donde n indica la cantidad de moles en la sustancia presente. Esta capacidad usualmente es función de la temperatura  .
.
 .
.Capacidad calorífica[editar]
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por  , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
Dado que:
De igual forma se puede definir la capacidad calórica molar como:
Cambios de fase[editar]
En la naturaleza existen tres estados usuales de la materia: sólido, líquido y gaseoso. Al aplicarle calor a una sustancia, ésta puede cambiar de un estado a otro. A estos procesos se les conoce como cambios de fase. Los posibles cambios de fase son:
- de estado sólido a líquido, llamado fusión,
- de estado líquido a sólido, llamado solidificación,
- de estado líquido a gaseoso, llamado evaporación o vaporización,
- de estado gaseoso a líquido, llamado condensación,
- de estado sólido a gaseoso, llamado sublimación progresiva,
- de estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- de estado gaseoso a plasma, llamado ionización.
- de estado plasma a gaseoso, llamado Desionización
Calor latente[editar]
Un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas a cualquier temperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata de sustancias diferentes. Pero lo que es menos evidente es que dos fases o estados de agregación, distintas de una misma sustancia, puedan estar en equilibrio térmico entre sí en circunstancias apropiadas.
Un sistema que consiste en formas sólida y líquida de determinada sustancia, a una presión constante dada, puede estar en equilibrio térmico, pero únicamente a una temperatura llamada punto de fusión simbolizado a veces como  . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
El calor de fusión representa la energía necesaria para deshacer la fase sólida que está estrechamente unida y convertirla en líquido. Para convertir líquido en sólido se necesita la misma cantidad de energía, por ello el calor de fusión representa la energía necesaria para cambiar del estado sólido a líquido, y también para pasar del estado líquido a sólido.
El calor de fusión se mide en cal / g.
De manera similar, un líquido y un vapor de una misma sustancia pueden estar en equilibrio térmico a una temperatura llamada punto de ebullición simbolizado por  . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por  .
.
 . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por  .
.
En la siguiente tabla se muestran algunos valores de los puntos de fusión y ebullición, y entalpías de algunas sustancias:
| sustancias |  [°C] [°C] |  [cal/g] [cal/g] |  [°C] [°C] |  [cal/g] [cal/g] |
| H2O | 0,00 | 79,71 | 100,00 | 539,60 |
| O2 | -219,00 | 3,30 | -182,90 | 50,90 |
| Hg | -39,00 | 2,82 | 357,00 | 65,00 |
| Cu | 1083,00 | 42,00 | 2566,90 |
Transmisión de calor[editar]
El calor puede ser transmitido de tres formas distintas: por conducción, por convección o por radiación.
- Conducción térmica: es el proceso que se produce por contacto térmico entre dos ó más cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico. Ej: cuchara metálica en la taza de té.
- Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura. El transporte de calor está inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
- Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa. Ej.: La energía solar.
La conducción pura se presenta sólo en materiales sólidos. La convección siempre está acompañada de la conducción, debido al contacto directo entre partículas de distinta temperatura en un líquido o gas en movimiento. En el caso de la conducción, la temperatura de calentamiento depende del tipo de material, de la sección del cuerpo y del largo del cuerpo. Esto explica por qué algunos cuerpos se calientan más rápido que otros a pesar de tener exactamente la misma forma, y que se les entregue la misma cantidad de calor.
- Conductividad térmica
La conductividad térmica de un cuerpo está dada por:
donde:
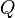 es el calor entregado,
es el calor entregado,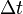 es el intervalo de tiempo durante el cual se entregó calor,
es el intervalo de tiempo durante el cual se entregó calor,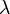 es el coeficiente de conductividad térmica propio del material en cuestión,
es el coeficiente de conductividad térmica propio del material en cuestión, es la sección del cuerpo,
es la sección del cuerpo, es la longitud, y
es la longitud, y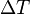 es el incremento en la temperatura.
es el incremento en la temperatura.CANTIDAD DE CALOR
Cuando una sustancia se está fundiendo o evaporándose está absorbiendo cierta cantidad de calor llamada calor latente de fusión o calor latente de evaporación, según el caso. El calor latente, cualquiera que sea, se mantiene oculto, pero existe aunque no se manifieste un incremento en la temperatura,ya que mientras dure la fundición o la evaporación de la sustancia no se registrará variación de la misma.Para entender estos conceptos se debe conocer muy bien la diferencia entre calor y temperatura.En tanto el calor sensible es aquel que suministrado a una sustancia eleva su temperatura.La experiencia ha demostrado que la cantidad de calor tomada (o cedida) por un cuerpo es directamente proporcional a su masa y al aumento (o disminución) de temperatura que experimenta.La expresión matemática de esta relación es la ecuación calorimétrica:
Q = m·Ce·(Tf-Ti)
 En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
Nota: La temperatura inicial (Ti) se anota también como T0 o como t0.Si Ti > Tf el cuerpo cede calor Q < 0Si Ti < Tf el cuerpo recibe calor Q > 0Se define calor específico (Ce) como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua Ce vale 1 cal/gº C ó 4,186 J.
MEDIDA DEL CALOR
De acuerdo con el principio de conservación de la energía, suponiendo que no existen pérdidas, cuando dos cuerpos a diferentes temperaturas se ponen en contacto, el calor tomado por uno de ellos ha de ser igual en cantidad al calor cedido por el otro. Para todo proceso de transferencia calorífica que se realice entre dos cuerpos puede escribirse entonces la ecuación:Q1 = - Q2en donde el signo - indica que en un cuerpo el calor se cede, mientras que en el otro se toma. Recurriendo a la ecuación calorimétrica, la igualdad anterior puede escribirse en la forma:m1 · c1 · (Te - T1) = -m2 · c2 · (Te - T2)(6)donde el subíndice 1 hace referencia al cuerpo frío y el subíndice 2 al caliente. La temperatura Te en el equilibrio será superior a T1 e inferior a T2.La anterior ecuación indica que si se conocen los valores del calor específico, midiendo temperaturas y masas, es posible determinar cantidades de calor. El aparato que se utiliza para ello se denomina calorímetro. Un calorímetro ordinario consta de un recipiente de vidrio aislado térmicamente del exterior por un material apropiado. Una tapa cierra el conjunto y dos pequeños orificios realizados sobre ella dan paso al termómetro y al agitador, los cuales se sumergen en un líquido llamado calorimétrico, que es generalmente agua.Cuando un cuerpo a diferente temperatura que la del agua se sumerge en ella y se cierra el calorímetro, se produce una cesión de calor entre ambos hasta que se alcanza el equilibrio térmico. El termómetro permite leer las temperaturas inicial y final del agua y con un ligero movimiento del agitador se consigue una temperatura uniforme. Conociendo el calor específico y la masa del agua utilizada, mediante la ecuación calorimétrica se puede determinar la cantidad de calor cedida o absorbida por el agua.En este tipo de medidas han de tomarse las debidas precauciones para que el intercambio de calor en el calorímetro se realice en condiciones de suficiente aislamiento térmico. Si las pérdidas son considerables no será posible aplicar la ecuación de conservación Q1 = - Q2 y si ésta se utiliza los resultados estarán afectados de un importante error.La ecuación (6) puede aplicarse únicamente a aquellos casos en los cuales el calentamiento o el enfriamiento del cuerpo problema no lleva consigo cambios de estado físico (de sólido a líquido o viceversa, por ejemplo). A partir de ella y con la ayuda del calorímetro es posible determinar también el calor específico del cuerpo si se conocen las temperaturas T1, T2 y Te, las masas m1 y m2 y el calor específico del agua.Proceso termodinámico
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada algunaligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a la desestabilización del sistema.
Tipos de procesos termodinámicos[editar]
Procesos Iso[editar]
Son los procesos cuyas magnitudes permanecen "constantes", es decir que el sistema cambia manteniendo cierta proporcionalidad en su transformación. Se les asigna el prefijo iso-.Ejemplo:- Isotérmico: proceso a temperatura constante
- Isobárico: proceso a presión constante
- Isométrico o isocórico: proceso a volumen constante
- Isoentálpico: proceso a entalpía constante
- Isoentrópico: proceso a entropía constante
Transferencia de calor
La transferencia de calor es el paso de energía térmica desde un cuerpo de mayor temperatura a otro de menor temperatura. Cuando un cuerpo, por ejemplo, un objeto sólido o un fluido, está a una temperatura diferente de la de su entorno u otro cuerpo, la transferencia de energía térmica, también conocida como transferencia de calor o intercambio de calor, ocurre de tal manera que el cuerpo y su entorno alcancen equilibrio térmico. La transferencia de calor siempre ocurre desde un cuerpo más caliente a uno más frío, como resultado del segundo principio de la termodinámica. Cuando existe una diferencia de temperatura entre dos objetos en proximidad uno del otro, la transferencia de calor no puede ser detenida; solo puede hacerse más lenta.
Modos de transferencia[editar]
Los modos de transferencia son diferentes procesos de transporte de calor, usualmente se agrupan en tres tipos según haya también transferencia o no transferencia de materia (o fotones)como los siguientes :- Conducción: Es la transferencia de calor que se produce a través de un medio estacionario -que puede ser un sólido- cuando existe una diferencia de temperatura.
- Convección: Se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas. La convección se produce únicamente por medio de materiales fluidos. Lo que se llama convección en sí, es el transporte de calor por medio del movimiento del fluido, por ejemplo: al trasegar el fluido por medio de bombas o al calentar agua en una cacerola, la que está en contacto con la parte de abajo de la cacerola se mueve hacia arriba, mientras que el agua que está en la superficie, desciende, ocupando el lugar que dejó la cacerola caliente.
- Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.1
Aislamiento y barreras de radiación[editar]
Los aislantes térmicos son materiales específicamente diseñados para reducir el flujo de calor limitando la conducción, convección o ambos. Las barreras de radiación, son materiales que reflejan la radiación, reduciendo así el flujo de calor de fuentes de radiación térmica. Los buenos aislantes no son necesariamente buenas barreras de radiación, y viceversa. Los metales, por ejemplo, son excelentes reflectores pero muy malos aislantes.La efectividad de un aislante está indicado por su resistencia (R). La resistencia de un material es el inverso del coeficiente de conductividad térmica (k) multiplicado por el grosor (d) del aislante. Las unidades para la resistencia son en el sistema internacional de unidades: (K·m²/W).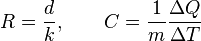 La fibra de vidrio rígida, un material aislante usado comúnmente, tiene un valor R de 4 por pulgada, mientras que el cemento, un mal conductor, tiene un valor de 0.08 por pulgada.2La efectividad de una barrera de radiación está indicado por su reflectividad, la cual es una fracción de la radiación reflejada. Un material con una alta reflectividad (en una longitud de onda) tiene una baja absorbitividad, y por consiguiente una baja emisividad. Un reflector ideal tiene un coeficiente de reflectividad igual a 1, lo que significa que refleja el 100% de la radiación entrante. Por otro lado, en el caso de uncuerpo negro, el cual tiene una excelente absorbitividad y emitividad de la radiación térmica, su coeficiente de reflectividad es casi 0. Las barreras de radiación tiene una gran aplicación en ingeniería aeroespacial; la gran mayoría de los satélites usan varias capas aislantes aluminizadas que reflejan la luz solar, lo que permite reducir la transferencia de calor y controlar la temperatura del satélite.
La fibra de vidrio rígida, un material aislante usado comúnmente, tiene un valor R de 4 por pulgada, mientras que el cemento, un mal conductor, tiene un valor de 0.08 por pulgada.2La efectividad de una barrera de radiación está indicado por su reflectividad, la cual es una fracción de la radiación reflejada. Un material con una alta reflectividad (en una longitud de onda) tiene una baja absorbitividad, y por consiguiente una baja emisividad. Un reflector ideal tiene un coeficiente de reflectividad igual a 1, lo que significa que refleja el 100% de la radiación entrante. Por otro lado, en el caso de uncuerpo negro, el cual tiene una excelente absorbitividad y emitividad de la radiación térmica, su coeficiente de reflectividad es casi 0. Las barreras de radiación tiene una gran aplicación en ingeniería aeroespacial; la gran mayoría de los satélites usan varias capas aislantes aluminizadas que reflejan la luz solar, lo que permite reducir la transferencia de calor y controlar la temperatura del satélite.Disciplinas académicas[editar]
Los fenómenos de transferencia son generalmente parte del programa de estudios de ingeniería aeroespacial, ingeniería electromecánica, ingeniería industrial, ingeniería química, ingeniería agrícola o ingeniería mecánica. Comúnmente, los conocimientos sobre termodinámica son una condición previa para el estudio de la transmisión de calor, dado que las leyes de la termodinámica son esenciales para comprender el mecanismo de la transferencia de calor. Otras disciplinas relacionadas con la transmisión de calor incluyen la conversión de energía, termofluidos y transferencia de materia.Los métodos de transferencia de calor se usan en las siguientes disciplinas, entre otras:- ingeniería de automoción
- sistemas electrónicos
- HVAC
- aislamiento
- procesamiento de materiales
- ingeniería de centrales de energía
Cambio de estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas (si se descarta la materia oscura).
Cambios de estado de agregación de la materia[editar]
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cadasustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denominasolidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denominaSublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Desionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a un plasma.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.Las diferentes transformaciones de fase de la materia en este caso las del agua son necesarias y provechosas para la vida y el sustento del hombre cuando se desarrollan normalmente.Los cambios de estado están divididos generalmente en dos tipos: progresivos y regresivos.- Cambios progresivos: Vaporización, fusión y sublimación progresiva.
- Cambios regresivos: Condensación, solidificación y sublimación regresiva
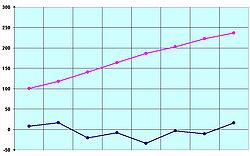
La siguiente tabla indica cómo se denominan los cambios de estado:Inicial\Final Sólido Líquido Gas Sólido fusión sublimación, sublimación progresiva o sublimación directa Líquido solidificación evaporación o ebullición Gas sublimación inversa, regresiva o deposición condensación y licuefacción (licuación) También se puede ver claramente con el siguiente gráfico:Punto de fusión[editar]
El punto de fusión es la temperatura a la cual la materia pasa de estado sólido a estado líquido, es decir, se funde.Al efecto de fundir un metal se le llama fusión (no podemos confundirlo con el punto de fusión). También se suele denominar fusión al efecto de licuar o derretir una sustancia sólida, congelada o pastosa, en líquida.En la mayoría de las sustancias, el punto de fusión y de congelación, son iguales. Pero esto no siempre es así: por ejemplo, el agar-agar se funde a 85 °C y se solidifica a partir de los 31 °C a 40 °C; este proceso se conoce como histéresis.En geología, se denomina punto de solidus a la temperatura en la que empieza a fundirse una roca y punto de liquidus a la temperatura en la que la fusión es total. Tanto la presencia de agua como una disminución de la presión pueden rebajar los puntos de solidus y liquidus de una roca, facilitando la formación de magmas sin aumentar la temperatura.1Punto de ebullición[editar]
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso, es decir se ebulle. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido. En esas condiciones se puede formar vapor en cualquier punto del líquido.La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de laspartículas que lo componen).El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo inducido o puentes de hidrógeno).
Equilibrio térmico
El equilibrio térmico es aquel estado en el cual se igualan las temperaturas de dos cuerpos, las cuales, en sus condiciones iniciales presentaban diferentes temperaturas. Una vez que las temperaturas se equiparan se suspende el flujo de calor, llegando ambos cuerpos al mencionado equilibrio térmico.
Definición termodinámica del equilibrio térmico[editar]
Para poder dar una definición más precisa del concepto de equilibrio térmico desde un punto de vista termodinámico es necesario definir algunos conceptos.Dos sistemas que están en contacto mecánico directo o separados mediante una superficie que permite la transferencia de calor lo que se conoce como superficie diatérmica, se dice que están en contacto térmico.Consideremos entonces dos sistemas en contacto térmico, dispuestos de tal forma que no puedan mezclarse o reaccionar químicamente. Consideremos además que estos sistemas están colocados en el interior de un recinto donde no es posible que intercambien calor con el exterior ni existan acciones desde el exterior capaces de ejercer trabajo sobre ellos. La experiencia indica que al cabo de un tiempo estos sistemas alcanzan un estado de equilibrio termodinámico que se denominará estado de equilibrio térmico recíproco o simplemente de equilibrio térmico.Interpretación microscópica del equilibrio térmico[editar]
La termodinámica proporciona una descripción macroscópica de los sistemas que estudia, sin hacer hipótesis acerca de la estructura microscópica de esos sistemas. Sin embargo, existen otras disciplinas, como lafísica estadística, que estudian los mismos fenómenos de la Termodinámica, pero desde un enfoque microscópico.En particular, el concepto de equilibrio térmico está ligado al concepto de temperatura al decir que dos sistemas en equilibrio térmico tienen la misma temperatura. Desde un punto de vista microscópico, la temperatura está asociada a la energía cinética promedio que tienen las partículas que constituyen el sistema, a saber, átomos, moléculas y/o la estructura electrónica de la sustancia que constituye el sistema. Macroscópicamente, esta energía cinética promedio de las partículas de un sistema es lo que en la Termodinámica se llama energía interna, que es una energía que depende casi exclusivamente de la temperatura del sistema. A mayor energía cinética promedio de las partículas que constituyen un sistema, mayor energía interna y, en general, mayor temperatura del sistema.La situación de dos sistemas en contacto térmico se interpreta microscópicamente como que las partículas de la superficie de interfase de ambos sistemas son capaces de interactuar entre sí. Básicamente se puede ver que, microscópicamente, las partículas del sistema de mayor temperatura (que tienen mayor energía cinética) van a transferir parte de su energía a las partículas del otro sistema. Se encuentra que esta interacción entre los dos sistemas da lugar a que las partículas de los dos sistemas alcancen la misma energía cinética promedio y, por lo tanto, la misma temperatura. Es decir, desde un punto de vista microscópico, se entiende como equilibrio térmico entre dos sistemas que las partículas de los dos sistemas tengan la misma energía cinética promedio.Desde un punto de vista macroscópico, se dice que los sistemas un estado de equilibrio, bajo las condiciones indicadas en la sección definición termodinámica del equilibrio térmico. En cambio, desde un punto de vista microscópico, el estado de equilibrio se refiere al promedio, ya que los dos sistemas continúan intercambiando energía incluso una vez alcanzado el equilibrio térmico. Sin embargo, la energía cinética individual de una partícula no es estacionaria, sino que es el promedio de la distribución de energías de todas las partículas del sistema lo que no cambia en el tiempo.De igual manera que para el caso macroscópico, se puede extender el concepto de equilibrio térmico a un único sistema donde, en esa situación de equilibrio, las partículas de dos partes cualesquiera del sistema tienen la misma energía cinética promedio.Ley Cero de la Termodinámica[editar]
El concepto de equilibrio térmico es la base de la llamada Ley Cero de la Termodinámica. Esta ley proposición fue enunciada por R. H. Fowler en 1931. La ley cero de la termodinámica se enuncia diciendo:La experiencia indica que si dos sistemas A y B se encuentran, cada uno por separado, en equilibrio térmico con un tercer sistema, que llamaremos C, entonces A y B se encuentran en equilibrio térmico entre sí.Aplicación del concepto de equilibrio térmico: Termometría[editar]
Para saber la temperatura de una sustancia o cuerpo, se utiliza un dispositivo que permite determinar su propia temperatura. Tal dispositivo se denomina termómetro. Para determinar la temperatura de un cuerpo, se pone un termómetro en contacto térmico con él hasta que ambos alcanzan el equilibrio térmico. Sabemos que en el equilibrio térmico tanto el cuerpo como el termómetro se encuentran a la misma temperatura. Por tanto, la temperatura que indique el termómetro será también la temperatura del cuerpo en cuestión. Se recalca que, lo que un termómetro indica es su propia temperatura, por esto es importante conocer el concepto de equilibrio térmico.Energía interna
En física, la energía interna (U) de un sistema intenta ser un reflejo de la energía a escala microscópica. Más concretamente, es la suma de:- la energía cinética interna, es decir, de las sumas de las energías cinéticas de las individualidades que lo forman respecto al centro de masas del sistema,
- la energía potencial interna, que es la energía potencial asociada a las interacciones entre estas individualidades.1
La energía interna no incluye la energía cinética traslacional o rotacional del sistema como un todo. Tampoco incluye la energía potencial que el cuerpo pueda tener por su localización en un campo gravitacional o electrostático externo.Si pensamos en constituyentes atómicos o moleculares, será el resultado de la suma de la energía cinética de las moléculas o átomos que constituyen el sistema (de sus energías de traslación, rotación y vibración) y de la energía potencial intermolecular (debida a las fuerzas intermoleculares) e intramolecular de la energía de enlace.- En un gas ideal monoatómico bastará con considerar la energía cinética de traslación de sus átomos.
- En un gas ideal poliatómico, deberemos considerar además la energía vibracional y rotacional de las mismas.
- En un líquido o sólido deberemos añadir la energía potencial que representa las interacciones moleculares.
Desde el punto de vista de la termodinámica, en un sistema cerrado (o sea, de paredes impermeables), la variación total de energía interna es igual a la suma de las cantidades de energía comunicadas al sistema en forma de calor y de trabajo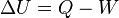 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo 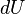 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.Índice
El enfoque termodinámico: la ecuación fundamental[editar]
En termodinámica se deduce la existencia2 de una ecuación de la formaconocida como ecuación fundamental en representación energética.La importancia de la misma radica en que concentra en una sola ecuación toda la información termodinámica de un sistema. La obtención de resultados concretos a partir de la misma se convierte entonces en un proceso sistemático.
Si calculamos su diferencial:
se definen sus derivadas parciales:- la temperatura

- la presión
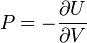
- el potencial químico
 .
.
Como T, P y son derivadas parciales de U, serán funciones de las mismas variables que U:Estas relaciones reciben el nombre de ecuaciones de estado. Por lo general no se dispone de la ecuación fundamental de un sistema. En ese caso sus sustitución por el conjunto de todas las ecuaciones de estado proporcionaría una información equivalente, aunque a menudo debamos conformarnos con un subconjunto de las mismas.
son derivadas parciales de U, serán funciones de las mismas variables que U:Estas relaciones reciben el nombre de ecuaciones de estado. Por lo general no se dispone de la ecuación fundamental de un sistema. En ese caso sus sustitución por el conjunto de todas las ecuaciones de estado proporcionaría una información equivalente, aunque a menudo debamos conformarnos con un subconjunto de las mismas.Algunas variaciones de la energía interna[editar]
Al aumentar la temperatura de un sistema, sin que varíe nada más, aumenta su energía interna reflejado en el aumento de la energía térmica del sistema completo o de la materia estudiada.Convencionalmente, cuando se produce una variación de la energía interna manifestada en la variación del calor que puede ser cedido, mantenido o absorbido se puede medir este cambio en la energía interna indirectamente por la variación de la temperatura de la materia.Variación sin cambio de estado[editar]
Sin que se modifique el estado de la materia que compone el sistema, se habla de variación de la energía interna sensible o calor sensible y se puede calcular de acuerdo a los siguientes parámetros;Donde cada término con sus unidades en el Sistema Internacional son:Q = es la variación de energía o de calor del sistema en un tiempo definido (J).Ce = calor específico de la materia (J/kg·K).m = masa. = temperatura final del sistema - temperatura inicial (K).
= temperatura final del sistema - temperatura inicial (K).Ejemplo[editar]
Calcular la energía total de un sistema compuesto de 1 g de agua en condiciones normales, es decir a la altura del mar, una atmósfera de presión y a 14 °C para llevarlo a 15º C, sabiendo que el Ce del agua es = 1 [cal/g·°C].Aplicando la fórmula y reemplazando los valores, tenemos;
y reemplazando los valores, tenemos;- Q = 1 [cal/g·°C] · 1 [g] · (15 - 14) [°C] = 1 [cal]
Energía cinética media de un gas ideal[editar]
 K = Constante de Boltzmann = 1,38·10-23 J/K
K = Constante de Boltzmann = 1,38·10-23 J/K =Velocidad media de la moléculaLas propiedades termodinámicas de un gas ideal pueden ser descritas por dos ecuaciones:La ecuación de estado de un gas ideal clásico que es la ley de los gases idealesy la energía interna a volumen constante de un gas ideal que queda determinada por la expresión:donde
=Velocidad media de la moléculaLas propiedades termodinámicas de un gas ideal pueden ser descritas por dos ecuaciones:La ecuación de estado de un gas ideal clásico que es la ley de los gases idealesy la energía interna a volumen constante de un gas ideal que queda determinada por la expresión:donde- P es la presión
- V es el volumen
- n es la cantidad de sustancia de un gas (en moles)
- R es la constante de los gases (8.314 J·K−1mol-1)
- T es la temperatura absoluta
- U es la energía interna del sistema
 es el calor específico adimensional a volumen constante, ≈ 3/2 para un gas monoatómico, 5/2 para un gas diatómico y 3 para moléculas más complejas.
es el calor específico adimensional a volumen constante, ≈ 3/2 para un gas monoatómico, 5/2 para un gas diatómico y 3 para moléculas más complejas.
- N es el número de partículas de gas
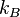 es la constante de Boltzmann (1.381×10−23J·K−1).
es la constante de Boltzmann (1.381×10−23J·K−1).
La distribución de probabilidad de las partículas por velocidad o energía queda determinada por la distribución de Boltzmann.Variación con modificación de la composición química[editar]
Si se produce alteración de la estructura atómica-molecular, como es el caso de las reacciones químicas o cambio de estado, se habla de variación de la energía interna química o variación de la energía internalatente.Esta condición de cambio de estado se puede calcular de acuerdo a:Donde = Coeficiente de cambio de estado, medido en [J/kg]Véase también: Entalpía
= Coeficiente de cambio de estado, medido en [J/kg]Véase también: EntalpíaMáquina térmica
Una máquina térmica es un conjunto de elementos mecánicos que permite intercambiar energía, generalmente a través de un eje, mediante la variación de energía de unfluido que varía su densidad significativamente al atravesar la máquina. Se trata de una máquina de fluido en la que varía el volumen específico del fluido en tal magnitud que los efectos mecánicos y los efectos térmicos son interdependientes.Por el contrario, en una máquina hidráulica, que es otro tipo de máquina de fluido, la variación de densidad es suficientemente pequeña como para poder desacoplar el análisis de los efectos mecánicos y el análisis de los efectos térmicos, llegando a despreciar los efectos térmicos en gran parte de los casos. Tal es el caso de una bomba hidráulica, a través de la cual pasa líquido. Alejándose de lo que indica la etimología de la palabra «hidráulica», también puede considerarse como máquina hidráulica unventilador, pues, aunque el aire es un fluido compresible, la variación de volumen específico no es muy significativa con el propósito de que no se desprenda la capa límite.En una máquina térmica, la compresibilidad del fluido no es despreciable y es necesario considerar su influencia en la transformación de energía.
Máquina térmica y motor térmico[editar]
En un principio se podría definir a una máquina térmica como un dispositivo, equipo o una instalación destinada a la producción de trabajo en virtud de un aporte calórico. Aunque en algunas definiciones se identifican como sinónimos los términos «máquina térmica motora» y «motor térmico», en otras se diferencian ambos conceptos. Al diferenciarlos, se considera que un motor térmico es un conjunto de elementos mecánicos que permite obtener energía mecánica a partir de la energía térmica obtenida mediante una reacción de combustión o una reacción nuclear. Un motor térmico dispone de lo necesario para obtener energía térmica, mientras que una máquina térmica motora necesita energía térmica para funcionar, mediante un fluido que dispone de más energía a la entrada que a la salida.1Clasificación[editar]
Según el sentido de transferencia de energía[editar]
Las máquinas térmicas pueden clasificarse, según el sentido de transferencia de energía, en:- Máquinas térmicas motoras, en las cuales la energía del fluido disminuye al atravesar la máquina, obteniéndose energía mecánica en el eje.
- Máquinas térmicas generadoras, en las cuales la energía del fluido aumenta al atravesar la máquina, precisándose energía mecánica en el eje.
Según el principio de funcionamiento[editar]
Atendiendo al principio de funcionamiento, las máquinas térmicas se clasifican en:- Máquinas volumétricas o máquinas de desplazamiento positivo, cuyo funcionamiento está basado en principios mecánicos e hidrostáticos, de manera que el fluido en algún instante está contenido en un volumen limitado por los elementos de la máquina. En este tipo de máquinas el flujo es pulsatorio. Se dividen a su vez en dos tipos según el movimiento del órgano propulsor: alternativas, cuyo movimiento es rectilíneo; y rotativas, cuyo movimiento es circular.
- Turbomáquinas, cuyo funcionamiento está basado en el intercambio de cantidad de movimiento entre el fluido y un rodete. En estas máquinas el flujo es continuo.
Teniendo en cuenta lo anterior, podemos clasificar las máquinas térmicas tal como se recoge en el cuadro siguiente.Máquinas térmicas Motoras Volumétricas Alternativas Máquina de vapor Rotativas Motor Wankel Turbomáquinas Turbina Generadoras Volumétricas Alternativas Compresor de émbolo Rotativas Compresor rotativo Turbomáquinas Turbocompresor Balance de energía en una máquina térmica[editar]
Un sistema abierto es aquel que intercambia materia y energía con el entorno. Aplicando el primer principio de la termodinámica para un sistema abierto, el incremento de energía del sistema en un intervalo de tiempo es: donde;
donde;- Q es el calor entregado al sistema. Será negativo cuando el calor sea entregado por el sistema.
- W es el trabajo entregado al sistema, en forma de trabajo mecánico y energía de presión. Será negativo cuando el calor sea entregado por el sistema.
- El subíndice in representa la materia que entra al sistema.
- El subíndice out representa la materia que sale del sistema.
- h es la entalpía por unidad de masa del flujo
- V2/2 es la energía cinética por unidad de masa del flujo.
- gz es la energía potencial por unidad de masa del flujo
Haciendo la derivada de la expresión anterior respecto al tiempo, se obtiene: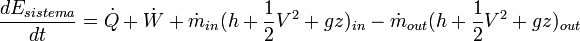 Debe tenerse en cuenta que en máquinas generadoras, puede aparecer esta expresión con el signo de W cambiado, para que se exprese el trabajo entregado por la máquina y así W sea positivo.Véase también: Criterio de signos termodinámico
Debe tenerse en cuenta que en máquinas generadoras, puede aparecer esta expresión con el signo de W cambiado, para que se exprese el trabajo entregado por la máquina y así W sea positivo.Véase también: Criterio de signos termodinámicoSimplificaciones[editar]
La ecuación que expresa el balance de energía puede simplificarse en los siguientes casos:- Sistema en reposo
Cuando el sistema está en reposo, tal como en máquinas estacionarias, las variaciones de energía potencial y energía cinética serán nulas.
- Régimen permanente
Cuando la máquina funciona en régimen permanente, las cantidades de masa y energía que entran son iguales a las que salen, pues de lo contrario variarían esa cantidades dentro del sistema.

- Variación de energía potencial despreciable
En la mayoría de las máquinas térmicas, diferencia de energía potencial del flujo que sale respecto al que entra es poco significativo en comparación con los otros términos asociados a la energía del flujo.
- Sistemas adiabáticos
En la mayoría de las máquinas térmicas, la transferencia de calor es despreciable frente a otros intercambios de energía. Teniendo en cuenta la transmisión de calor por conducción y convección:donde Q es el calor intercambiado, U es el coeficiente global de transferencia de calor, A es la superficie del sistema y es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:
es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:- La superficie externa del sistema está bien aislada térmicamente.
- La superficie externa del sistema es muy pequeña.
- La diferencia de temperaturas entre el flujo y el entorno del sistema es pequeña.
- El fluido pasa a través de la máquina tan rápido que apenas hay tiempo para que sea significativa la transferencia de calor por unidad de masa.
Máquina térmica en régimen permanente con variación de energía potencial despreciable[editar]
En una máquina térmica que funciona en régimen permanente en la cual se desprecie la variación de energía potencial, la expresión el primer principio de la termodinámica puede expresarse como![\dot W = \dot m [(h + \frac{V^{2}}{2})_{out} - (h + \frac{V^{2}}{2})_{in}] = \dot m [ h_{0 out} - h_{0 in} ]](https://upload.wikimedia.org/math/0/4/b/04ba969e4508721476a6c9dd9a6e36c2.png) donde h0 es la entalpía de parada.En los ciclos termodinámicos asociados a la turbina de vapor, la energía cinética específica puede considerarse despreciable frente a la entalpía, resultando
donde h0 es la entalpía de parada.En los ciclos termodinámicos asociados a la turbina de vapor, la energía cinética específica puede considerarse despreciable frente a la entalpía, resultando![\dot W = \dot m [(h + \frac{V^{2}}{2})_{out} - (h + \frac{V^{2}}{2})_{in}] = \dot m [ h_{0 out} - h_{0 in} ]](https://upload.wikimedia.org/math/0/4/b/04ba969e4508721476a6c9dd9a6e36c2.png)
Rendimiento[editar]
Para el cálculo del rendimiento, se relaciona la energía obtenida, ya sea en forma de incremento de energía en el fluido o de energía mecánica suministrada por la máquina, entre la máxima energía que se podría obtener en las condiciones de contorno.Rendimiento de una máquina térmica motora[editar]
- Rendimiento interno
El trabajo específico máximo que puede obtenerse en la expansión de un fluido está definido por la diferencia de entalpías entre el fluido a la entrada y las condicionesisoentrópicas a la presión de salida. En cambio el trabajo real es menor a éste debido al aumento de la entropía.2- Rendimiento mecánico
El rendimiento mecánico es la relación entre potencia efectiva (( ), que es la potencia obtenida en el eje, y la potencia interna ((
), que es la potencia obtenida en el eje, y la potencia interna (( ), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas (
), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas ( ), que es disipada el rozamientode elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
), que es disipada el rozamientode elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)- Rendimiento isoentrópico
El rendimiento isoentrópico relaciona la potencia obtenida en el eje con potencia máxima del proceso isoentrópico en las mismas condiciones de contorno.Rendimiento de una máquina térmica generadora[editar]
- Rendimiento interno
El trabajo específico mínimo para comprimir un fluido desde un estado térmico hasta una presión determinada es igual al salto entálpico del correspondiente proceso isoentrópico, de forma que un proceso real presentará mayor diferencia de entalpías del fluido entre la entrada y la salida.2- Rendimiento mecánico
El rendimiento mecánico es la relación entre potencia efectiva (( ), que es la potencia obtenida en el eje, y la potencia interna ((
), que es la potencia obtenida en el eje, y la potencia interna (( ), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas (
), que es la variación por unidad de tiempo de la energía del fluido. La potencia efectiva resulta de restar a la potencia indicada menos la potencia de pérdidas mecánicas ( ), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)
), que es disipada el rozamiento de elementos mecánicos (cojinetes, retenes, etc.) y en el accionamiento de elementos auxiliares (bomba de aceite, ventiladores, etc.)- Rendimiento isoentrópico
El rendimiento isoentrópico relaciona potencia mínima del proceso isoentrópico en las mismas condiciones de contorno con la potencia suministrada en el eje.



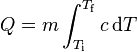









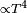 y la convección
y la convección  .
.






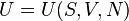



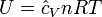
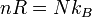 donde
donde